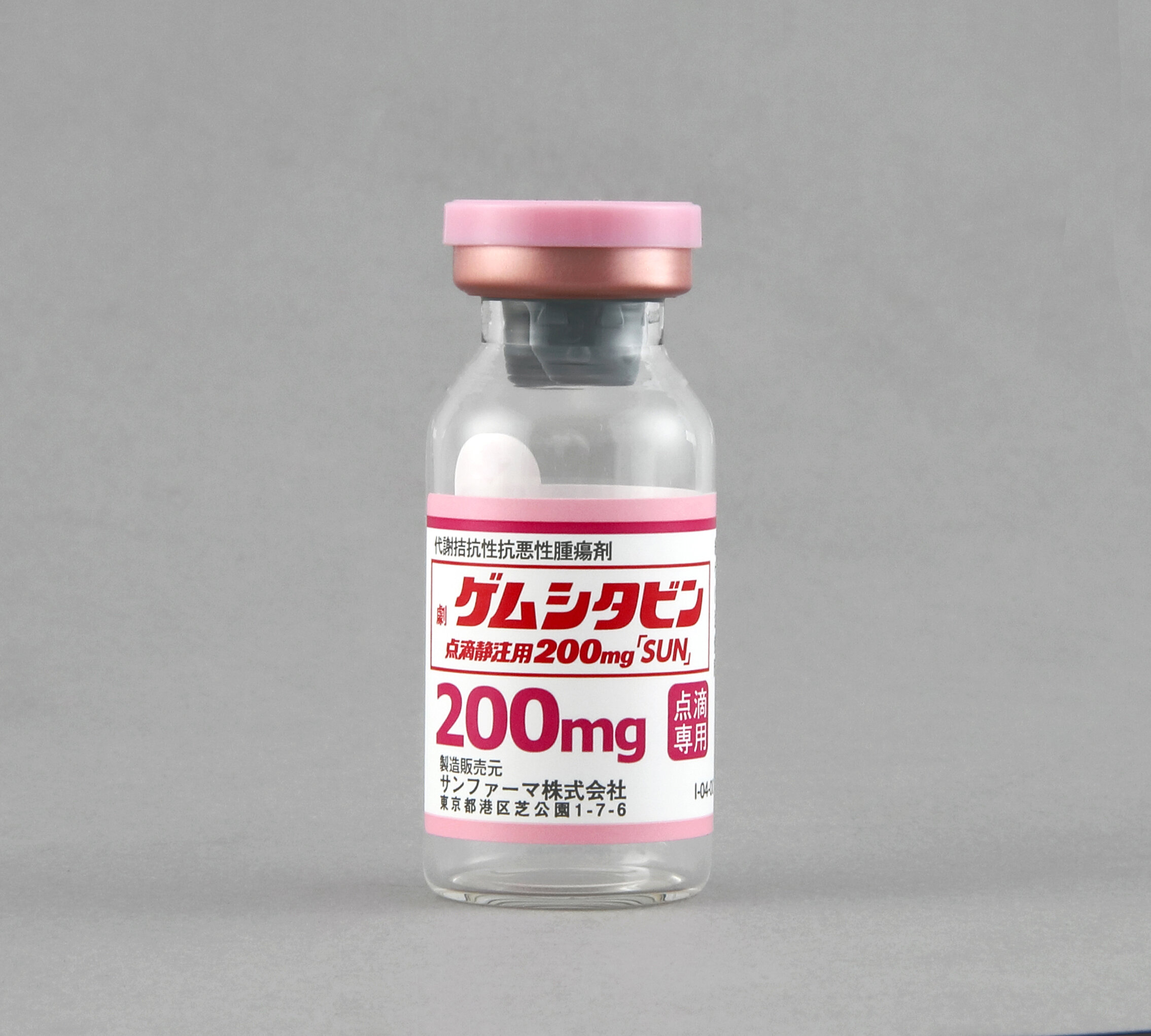
製品概要
| 先発品名 | ジェムザール注射用200mg |
|---|---|
| 一般名 | ゲムシタビン塩酸塩 |
| 薬効分類名 | 代謝拮抗性抗悪性腫瘍剤 |
| 適応症 | 非小細胞肺癌、膵癌、胆道癌、尿路上皮癌、手術不能又は再発乳癌、がん化学療法後に増悪した卵巣癌、再発又は難治性の悪性リンパ腫 |
| 先発品との「効能・効果」、「用法・用量」の同異 | 同じ |
| 添加物 | D-マンニトール200mg、酢酸ナトリウム水和物20.7mg、pH調節剤 |
各種コード
この表は横にスクロールできます
| 包装 | 1バイアル | 薬価基準収載医薬品コード | 4224403D1146 | |
|---|---|---|---|---|
| YJコード | 4224403D1146 | HOTコード(13桁) | 1197020020101 | |
| レセプト電算処理コード | 621970202 | GS1コード | 調剤単位 | 04987047210103 |
| 統一商品コード | 047110106 | 販売単位 | 14987047110103 | |
| 梱包単位 | 24987047110100 | |||
各種資料
- 添付文書
- 総合製品情報概要
- インタビューフォーム
- RMP・適正使用ガイド
-
使用上の注意改訂
のお知らせ - 服薬指導ガイド
- 患者向け医薬品ガイド
- くすりのしおり
- 標準品との比較表
- 配合変化表
- 包装変更のお知らせ
- その他のお知らせ
よくあるご質問
本製品について、よくいただくご質問と回答をまとめましたのでご確認ください。
- 【製剤】ゲムシタビン点滴静注用200mg「SUN」の製剤識別性の特徴を教えてください。
-
バイアルの識別性を高めるために、プラスチックキャップを規格別に色分けし、製品名や含量を表示したのに加え、アルミ部も色分けして製品名や含量を表示し、プラスチックキャップを取り外しても容易に識別できるようにしています。
※ゲムシタビンの製剤写真をご参照ください。
- 【製剤】ゲムシタビン点滴静注用200mg「SUN」のバイアルの口径を教えてください。
-
ゲムシタビン点滴静注用200mg「SUN」の口径サイズは以下のとおりです。
口外径:19.7mm
口内径:12.5mm
※ゲムシタビン点滴静注用1g「SUN」の口径サイズも同じです。
- 【用法】週1回投与を30分間点滴静注により行うのは、何故ですか。
-
本剤の投与時間が60分以上となると毒性が増強されることが示唆されたためです 1)。
点滴時間が長いと細胞内活性体の濃度が高くなり、そのため殺細胞効果に関連した副作用(骨髄抑制など)が増強されるものと考えられます。
出典:
- 1)Pollera CF et al. Investigational New Drugs 1997; 15(2):115-121
- 【安全性】重大な副作用は何ですか。
-
- 1)骨髄抑制:白血球減少、好中球減少、血小板減少、貧血[ヘモグロビン減少、赤血球減少]等があらわれることがあるので、血液学的検査を頻回に行い、異常が認められた場合には、減量、休薬等適切な処置を行ってください。なお、高度な白血球減少に起因したと考えられる敗血症による死亡例が報告されています。
- 2)間質性肺炎:間質性肺炎があらわれることがあるので、胸部X線検査等を行うなど観察を十分に行い、異常が認められた場合には、投与を中止し、適切な処置を行ってください。なお、間質性肺炎に起因したと考えられる死亡例が報告されています。
- 3)アナフィラキシー:呼吸困難、血圧低下、発疹等の症状があらわれることがあるので、観察を十分に行い、このような症状があらわれた場合には、投与を中止し、適切な処置を行ってください。
- 4)心筋梗塞:心筋梗塞がみられることがあります。
- 5)うっ血性心不全:うっ血性心不全があらわれることがあります。
- 6)肺水腫:肺水腫があらわれることがあります。
- 7)気管支痙攣:気管支痙攣があらわれることがあります。
- 8)成人呼吸促迫症候群(ARDS):成人呼吸促迫症候群(ARDS)があらわれることがあります。
- 9)腎不全:腎不全があらわれることがあります。
- 10)溶血性尿毒症症候群:溶血性尿毒症症候群があらわれることがあるので、血小板減少、ビリルビン上昇、クレアチニン上昇、BUN上昇、LDH上昇を伴う急速なヘモグロビン減少等の微小血管症性溶血性貧血の兆候が認められた場合には、投与を中止してください。腎不全は投与中止によっても不可逆的であり、透析療法が必要となることもあります。
- 11)皮膚障害:重篤な皮膚障害(紅斑、水疱、落屑等)があらわれることがあります。
- 12)肝機能障害、黄疸:AST(GOT)、ALT(GPT)、Al-Pの上昇等の重篤な肝障害、黄疸があらわれることがあります。
- 13)白質脳症(可逆性後白質脳症症候群を含む):白質脳症(可逆性後白質脳症症候群を含む)があらわれることがあるので、高血圧、痙攣、頭痛、視覚異常、意識障害等の症状が認められた場合には投与を中止し、適切な処置を行ってください。
出典:
添付文書【使用上の注意】4.(1)重大な副作用
- 【安全性】本剤による間質性肺炎等の肺毒性に関する注意事項について教えてください。
-
胸部単純X線写真で明らかで、かつ臨床症状のある間質性肺炎又は肺線維症のある患者では、本剤の投与により症状が増悪し、致命的となることがあるので、禁忌です。
間質性肺炎等の重篤な副作用が起こることがあり、ときに致命的な経過をたどることがあります。本剤の投与にあたっては、臨床症状(呼吸状態、咳及び発熱等の有無)を十分に観察し、定期的に胸部X線検査を行ってください。また、必要に応じて胸部CT検査、動脈血酸素分圧(PaO2)、肺胞気動脈血酸素分圧較差(A-aDO2)、肺拡散能力(DLco)などの検査を行い、異常が認められた場合には、減量、休薬等の適切な処置を行ってください。間質性肺炎等の肺毒性の発症あるいは急性増悪が疑われた場合には、直ちに本剤による治療を中止し、ステロイド治療等の適切な処置を行ってください。出典:
添付文書【禁忌(次の患者には投与しないこと)】2.
添付文書【使用上の注意】2.(2)2)間質性肺炎等の肺毒性
- 【安全性】本剤による骨髄抑制に関する注意事項について教えてください。
-
骨髄抑制等の重篤な副作用が起こることがあり、ときに致命的な経過をたどることがあるので、高度な骨髄抑制のある患者への投与は禁忌です。本剤の投与にあたっては、白血球数及び血小板数の変動に十分留意し、投与当日の白血球数が2000/μL未満又は血小板数が7万/μL未満であれば、骨髄機能が回復するまで投与を延期してください。また、前治療により、骨髄機能が低下している患者では、骨髄抑制が強くあらわれることがあるので、これらの患者では投与量を適宜減量し、臨床検査値に十分注意してください。本剤を週1回3週連続投与した場合、白血球数及び好中球数の最低値は投与開始平均約2~3週間後にあらわれ、最低値発現日から約1週間で回復します。
出典:
添付文書【禁忌(次の患者には投与しないこと)】1.
添付文書【使用上の注意】2.(2)1)骨髄抑制
- 【安全性】腎障害患者に対する投与について教えてください。
-
腎障害のある患者では腎機能が低下しているので、副作用があらわれやすくなることがあります。慎重な投与をお願いします。
出典:
添付文書【使用上の注意】1. 慎重投与(4)
- 【安全性】透析患者への投与について教えてください。
-
現時点において、透析患者への明確な投与方法は確立していません。未変化体の薬物動態は腎機能正常者と同じですが、代謝物のクリアランスは低下すると報告されております。また、代謝物の血液透析による除去率は50%と高いことの報告もございます。国内外の症例報告では、ゲムシタビン投与の6~24時間後に透析を行ったと報告されています1-3)。
出典:
- 1)Kiani A, et al. Cancer Chemother Pharm 2003; 51(3): 266-270
- 2)Masumori N, et al. Jap J Clin Oncol 2008; 38(3): 182-185
- 3)透析患者への投薬ガイドブック 改訂3版 p.935-p.936、じほう社
- 【安全性】肝障害患者に対する投与について教えてください。
-
肝障害(肝転移、肝炎、肝硬変等)、アルコール依存症の既往又は合併がある患者では、肝機能の悪化を引き起こすことがあります。慎重な投与をお願いします。
出典:
添付文書【使用上の注意】1. 慎重投与(3)
- 【安全性】妊婦への投与について教えてください。
-
動物実験(マウス、ウサギ)で催奇形作用及び胎児致死作用が報告されています。妊婦又は妊娠している可能性のある女性には投与しないでください。妊娠可能な女性には、本剤投与中及び本剤投与終了後一定期間は適切な避妊を行うよう指導してください。
パートナーが妊娠する可能性のある男性には、本剤投与中及び本剤投与終了後一定期間は適切な避妊を行うよう指導してください。出典:
添付文書【禁忌】6,【使用上の注意】6. 妊婦、産婦、授乳婦等への投与(1)、(2)
- 【安全性】授乳婦への投与について教えてください。
-
動物実験(ラット)で乳汁中への移行が報告されています。授乳婦に投与する場合には、授乳を中止させてください。
出典:
添付文書【使用上の注意】6. 妊婦、産婦、授乳婦等への投与(3)
- 【安全性】小児への投与について教えてください。
-
使用経験がないため、小児等に対する安全性は確立されていません。
出典:
添付文書【使用上の注意】7. 小児等への投与
- 【安全性】高齢者への投与について教えてください。
-
高齢者では腎機能、肝機能等の生理機能が低下していることが多いため、高い血中濃度が持続するおそれがあるので、骨髄抑制等の副作用の発現に注意して、慎重な投与をお願いします。
出典:
添付文書【使用上の注意】5. 高齢者への投与
- 【安全性】放射線との併用はできますか。
-
外国の臨床試験でゲムシタビン塩酸塩と胸部への根治的放射線療法との併用により、重篤な食道炎、肺臓炎が発現し、死亡に至った例が報告されているので、胸部への放射線療法を施行している患者への同時併用は禁忌です。
また、腹部への放射線照射との併用は併用注意です。放射線照射との併用の基礎試験で、本剤は濃度依存的に放射線照射の効果を増強し、本剤による放射線感受性増加が認められています。出典:
添付文書【禁忌】
添付文書【使用上の注意】3. 相互作用
- 【安全性】血管外漏出時の危険性とその処置を教えてください。
-
ゲムシタビンは、炎症性薬剤に区分されます。
血管外漏出が認められた場合、院内の血管外漏出時の対応フローチャートに沿って対応してください。
本剤に対する解毒剤はありません。血管外漏出が認められた場合は、注射針を抜かずに直ちに薬剤注入を停止してください。可能な限り薬剤を吸引除去し、陰圧をかけながら留置針を抜去します(チューブや注射針に残存する薬液除去目的で行う)。
その後、ステロイド局注、冷却、局所麻酔剤で炎症や疼痛を抑える処置を行い、経過観察してください。皮膚壊死を疑う場合には、早期に皮膚科などの専門医に相談してください1)。出典:
- 1)がん診療レジデントマニュアル第8版(国立がん研究センター内科レジデント編 医学書院)2019; 459,461