製品概要
| 一般名 | チルドラキズマブ(遺伝子組換え) |
|---|---|
| 薬効分類名 | ヒト化抗ヒトIL-23p19モノクローナル抗体製剤 |
| 適応症 | 既存治療で効果不十分な尋常性乾癬 |
| 添加物 | L-ヒスチジン 0.495mg、L-ヒスチジン塩酸塩水和物 1.42mg、ポリソルベート80 0.5mg、精製白糖 70.0mg |
各種コード
この表は横にスクロールできます
| 包装 | 1本(1mL) | 薬価基準収載医薬品コード | 3999456G1025 | |
|---|---|---|---|---|
| YJコード | 3999456G1025 | HOTコード(13桁) | 1990867010101 | |
| レセプト電算処理コード | 629908601 | GS1コード | 調剤単位 | 04987047210042 |
| 統一商品コード | 047110045 | 販売単位 | 14987047110042 | |
| 梱包単位 | 24987047110049 | |||
各種資料
- 添付文書
- 総合製品情報概要
- インタビューフォーム
- RMP・適正使用ガイド
- 使用上の注意改訂の
お知らせ - 服薬指導ガイド
- 患者向け医薬品ガイド
- くすりのしおり
- 標準品との比較表
- 配合変化表
- 包装変更のお知らせ
- その他のお知らせ
診療サポート(患者向け指導せん)
よくあるご質問
本製品について、よくいただくご質問と回答をまとめましたのでご確認ください。
- 【製剤・安定性】チルドラキズマブとは?その作用機序は?
-
チルドラキズマブは、ヒトインターロイキン(IL)-23のp19サブユニットと特異的に結合するヒト化免疫グロブリンG1/κモノクローナル抗体製剤です。 446個のアミノ酸残基からなるH鎖(γ1鎖)2本及び214個のアミノ酸残基からなるL鎖(κ鎖)2本で構成される糖タンパク質(分子量:約147,000)で、マウス抗ヒトIL-23α(p19)サブユニット抗体の相補性決定部、ヒトフレームワーク部及びヒトIgG1の定常部から構成されており、チャイニーズハムスター卵巣細胞を用いて製造されます。
チルドラキズマブはIL-23とIL-23受容体との結合を阻害し、IL-23受容体を介した細胞内シグナル伝達及びサイトカインの産生カスケードを抑制します。
乾癬皮膚病変でIL-23が過剰発現していることが報告されており、チルドラキズマブを用いてIL-23の活性を阻害することにより尋常性乾癬への有効性を示すと考えられています。出典:
インタビューフォーム、審査報告書
- 【製剤・安定性】インターロイキン-23(IL-23)とは?
-
IL-23は17型ヘルパーT細胞の維持及び活性化により、自己免疫疾患の発症に関与する炎症性サイトカインです。乾癬、強直性脊椎炎、関節症性乾癬、及びクローン病を含む免疫疾患の発症に関与しています。また、炎症モデル動物でIL-23を阻害すると組織障害や炎症所見の回復が認められたことなどから、炎症性自己免疫疾患の発症に重要な役割を果たしていることがわかっています。
チルドラキズマブはIL-23に結合し、受容体への結合を阻止することによりIL-23の生物学的活性を中和し、IL-23に依存する細胞のシグナル伝達及び炎症誘発性のサイトカインの放出を阻害します。出典:
インタビューフォーム、審査報告書
- 【製剤・安定性】有効血中濃度は?
-
チルドラキズマブの治療上有効な血中濃度についてのデータはありません。
乾癬患者(日本人及び外国人の併合データ)にチルドラキズ100mgを初回、4週後、以降12週間隔で投与したところ、最初の16週までに定常状態に達し、定常状態におけるCmaxの幾何平均値(CV%)は8.1μg/mL(34%)、日本人乾癬患者に同様に投与した際の16週時のトラフ濃度の平均値±SDは1.13±0.821μg/mLであり、中等症から重度の乾癬患者におけるPASI75達成率、PGA0/1達成率が評価されているように、1回100mgを初回、4週後、以降12週間隔で皮下投与することで有効性を示すと判断されています。
なお、チルドラキズマブ100mg投与における効果不十分例に対する増量効果について検討した結果、チルドラキズマブ200mg投与への明確な増量効果は認められていないとしています。
※「既存治療で効果不十分な尋常性乾癬」に対して承認されている用法・用量は、「通常、成人にはチルドラキズマブ(遺伝子組換え)として、1回100mgを初回、4週後、以降12週間隔で皮下投与する。」です。出典:
インタビューフォーム、審査報告書
- 【製剤・安定性】薬物動態パラメータ(半減期、AUC等)は?
-
日本人健康成人にチルドラキズマブ(50、200、400mg)を単回皮下投与したときの薬物動態パラメータは以下の通りです。日本人健康成人にチルドラキズマブ50mg、200mg及び400mgを単回皮下投与したとき、血漿中チルドラキズマブ濃度が最高血漿中濃度に達した日数[中央値(範囲)]は、それぞれ13(6.0~13.3)日、6(2.0~14.0)日、4.5(3.0~27.1)日、平均消失半減期(t1/2)の平均値±SDは、それぞれ25.4±2.70日、27.3±4.04日、22.5±2.23日でした。
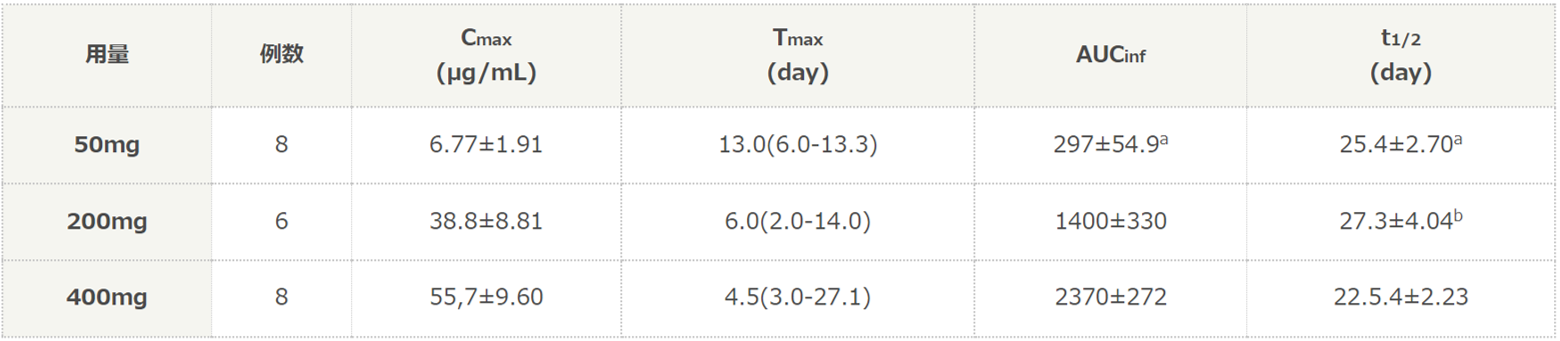
平均値±SD [Tmaxは例外とし、中央値(範囲)で表した]
a:6例
b:5例※「既存治療で効果不十分な尋常性乾癬」に対して承認されている用法・用量は、「通常、成人にはチルドラキズマブ(遺伝子組換え)として、1回100mgを初回、4週後、以降12週間隔で皮下投与する。」です。
出典:
添付文書、インタビューフォーム
- 【製剤・安定性】代謝、排泄経路は?
-
チルドラキズマブはモノクローナル抗体であり、代謝により一般的なタンパク質分解過程を経てペプチド及びアミノ酸へと分解され、再利用又は排泄されると考えられることから、全身組織への分布や代謝及び排泄に関する試験は実施していません(胎盤通過性及び乳汁中排泄を除く)。
出典:
インタビューフォーム、審査報告書
- 【製剤・安定性】製剤の安定性試験の結果は?
-
製剤の安定性試験の結果を以下に示します。
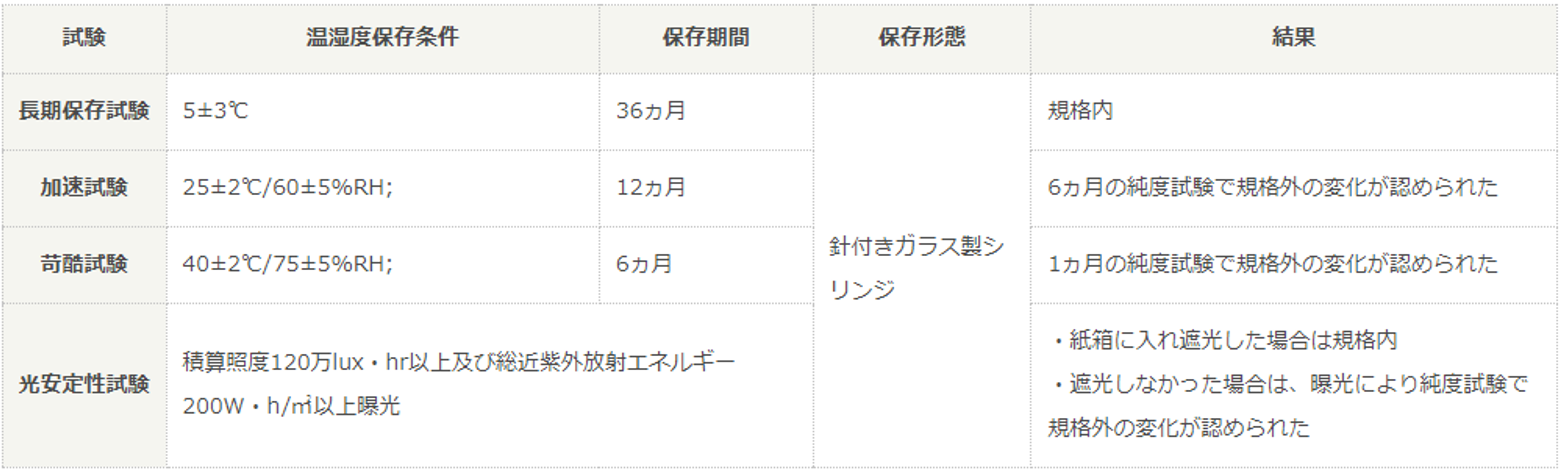
測定項目:性状、不溶性遺物、pH、純度試験、生物活性、定量等
出典:
インタビューフォーム
- 【製剤・安定性】製剤の廃棄方法は?
-
使用済みシリンジは各医療施設で他のディスポーザルシリンジ(ガラス)と同様に医療廃棄物として処分してください。また、直接包装のニードルシールドと個装箱は各医療施設のルールに従って廃棄して下さい。
なお、自己注射製剤ではないので廃棄ボックスは提供しておりません。
- 【投与方法】投与方法は?注射部位は?
-
イルミアは皮下注射製剤です。投与部位は、無症状の皮膚のうち注射しやすい部位(大腿部、腹部又は上腕部など)を選択し、皮膚が敏感な部位や、傷、発赤、硬結がある部位、乾癬部位には注射しないでください。また、同一箇所へ繰り返し注射は避けてください。なお、当該製品は1回使用の製剤であり、再使用しないようお願いしています。
出典:
添付文書
- 【投与方法】製剤を使用する前に注意する点はありますか?
-
投与30分前に冷蔵庫から取り出し、室温に戻してから投与してください。
使用前に、プレフィルドシリンジを目視で確認してください。色調は、無色~わずかに黄色です。また、小さい気泡を認めることがありますが問題ありません。
薬液に肉眼で大きな粒子を認める場合や、混濁していたり、液体が褐色になっているなど明らかに変色している場合は当該製品を使用しないようにしてください。出典:
欧州添付文書(2021年5月18日版)
- 【投与方法】自己注射はできますか?
-
自己注射はできません。医療機関を受診し、医療従事者(医師又は医師による直接の監督のもとでの医療従事者)によって、皮下注射で投与します。
出典:
添付文書
- 【投与方法】適切な投与間隔で投与できなかった場合の対応は?
-
患者さんがチルドラキズマブ導入後に予定通りに受診ができない場合や、受診を忘れた場合は、気づいた時点で速やかに医師に連絡していただき、できるだけ早く受診してチルドラキズマブの投与を受けるよう指導してください。
なお、推奨する訳ではありませんがご参考として、チルドラキズマブの臨床試験では、プロトコル上、チルドラキズマブ導入後28週以降の12週毎の皮下注射投与において、±7日の猶予期間が設定されています。※「既存治療で効果不十分な尋常性乾癬」に対して承認されている用法・用量は、「通常、成人にはチルドラキズマブ(遺伝子組換え)として、1回100mgを初回、4週後、以降12週間隔で皮下投与する。」です。
出典:
インタビューフォーム、審査報告書
- 【投与方法】薬液に気泡がありますが、空気抜きは必要ですか?
-
気泡があっても注射時の空気抜きは必要ありません。
出典:
米国添付文書(2018年3月版)
- 【特殊患者】妊婦に使用した報告はありますか?催奇形性はありますか?
-
添付文書では、「妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤はカニクイザルにおいて胎児への移行が報告されているが、胚・胎児毒性及び催奇形性は認められていない。」と記載しています。
妊婦におけるチルドラキズマブの使用に関するデータは限られており、胚及び胎児の発達に有害な転帰をもたらすリスクを評価するには不十分です。
また、チルドラキズマブの臨床開発試験では、妊娠中の女性は試験に参加できませんでした。出典:
添付文書、インタビューフォーム
- 【特殊患者】授乳婦に使用した報告はありますか?乳汁に移行しますか?
-
添付文書では、「本剤のヒトにおける乳汁中への移行は不明であるが、動物実験(カニクイザル)で乳汁中に移行することが報告されていることから、治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。」と記載しています。
ヒトでの乳汁中移行、授乳中の乳児に対する影響、母乳分泌に対する影響についてのデータはなく、安全性は確立されていません。授乳婦への投与は、本剤の有益性及び母乳栄養の有益性を十分に考慮し、授乳の継続又は中止を検討の上で慎重に投与してください。
なお、チルドラキズマブの臨床開発試験では、授乳婦は試験に参加できませんでした。出典:
添付文書、インタビューフォーム
- 【特殊患者】小児に使用した報告はありますか?
-
小児等を対象とした臨床試験は実施しておらず、チルドラキズマブ使用における安全性は確立されていません。なお、第Ⅲ相臨床試験の組み入れ基準は18歳以上でした。
添付文書では、「小児等を対象とした臨床試験は実施していない。」と記載しています。出典:
添付文書、インタビューフォーム
- 【安全性】警告について
-
添付文書では、警告について以下の記載をしています。
1. 警告
1.1 本剤は結核等の感染症を含む緊急時に十分に対応できる医療施設において、本剤についての十分な知識と適応疾患の治療に十分な知識・経験をもつ医師のもとで、本剤による治療の有益性が危険性を上回ると判断される患者のみに使用すること。本剤は感染症のリスクを増大させる可能性があり、また結核の既往歴を有する患者では結核を活動化させる可能性がある。また、本剤との関連性は明らかではないが、悪性腫瘍の発現が報告されている。治療開始に先立ち、本剤が疾病を完治させる薬剤でないことも含め、本剤の有効性及び危険性を患者に十分説明し、患者が理解したことを確認した上で治療を開始すること。[2.1、2.2、8.1、8.2、8.5、9.1.1、9.1.2、11.1.1、15.1.3 参照]
1.2 重篤な感染症
ウイルス及び細菌等による重篤な感染症が報告されているため、十分な観察を行うなど感染症の発症に注意し、本剤投与後に感染症の徴候又は症状があらわれた場合には、速やかに担当医に連絡するよう患者を指導すること。[2.1、8.1、9.1.1、11.1.1 参照]
1.3 本剤の治療を開始する前に、光線療法を含む既存の全身療法(生物製剤を除く)の適用を十分に勘案すること。出典:
添付文書
- 【安全性】禁忌について
-
添付文書では、禁忌について以下の記載をしています。
2. 禁忌(次の患者には投与しないこと)
2.1 重篤な感染症の患者[症状を悪化させるおそれがある。][1.1、1.2、8.1、11.1.1 参照]
2.2 活動性結核の患者[症状を悪化させるおそれがある。][1.1、8.2 参照]
2.3 本剤の成分に対し過敏症の既往歴のある患者出典:
添付文書
- 【安全性】特定の背景を有する患者に関する注意について
-
添付文書では、添付文書では、特定の背景を有する患者に関する注意について以下の記載をしています。
9. 特定の背景を有する患者に関する注意
9.1 合併症・既往歴等のある患者
9.1.1 感染症(重篤な感染症を除く)の患者又は感染症が疑われる患者
感染症が悪化するおそれがある。[1.1、1.2、8.1、11.1.1 参照]
9.1.2 結核の既往歴を有する患者又は結核感染が疑われる患者
結核症の発現に十分に注意すること。
(1)結核の既往歴を有する患者では、結核を活動化させるおそれがある。[1.1、8.2 参照]
(2)結核の既往歴を有する場合及び結核感染が疑われる場合には、結核の診療経験がある医師に相談すること。以下のいずれかの患者には、原則として抗結核薬を投与した上で、本剤を投与すること。[1.1、8.2 参照]
・胸部画像検査で陳旧性結核に合致するか推定される陰影を有する患者
・結核の治療歴(肺外結核を含む)を有する患者
・インターフェロンγ遊離試験やツベルクリン反応検査等の検査により、既感染が強く疑われる患者
・結核患者との濃厚接触歴を有する患者
9.5 妊婦
妊婦又は妊娠している可能性のある女性には、治療上の有益性が危険性を上回ると判断される場合にのみ投与すること。本剤はカニクイザルにおいて胎児への移行が報告されているが、胚・胎児毒性及び催奇形性は認められていない。
9.6 授乳婦
治療上の有益性及び母乳栄養の有益性を考慮し、授乳の継続又は中止を検討すること。本剤のヒトにおける乳汁中への移行は不明であるが、動物実験(カニクイザル)で乳汁中に移行することが報告されている。
9.7 小児等
小児等を対象とした臨床試験は実施していない。出典:
添付文書
- 【安全性】重要な基本的注意について
-
添付文書では、重要な基本的注意について以下の記載をしています。
8. 重要な基本的注意
8.1 本剤は、感染のリスクを増大させる可能性がある。そのため、本剤の投与に際しては、十分な観察を行い、感染症の発症や増悪に注意すること。感染症の徴候又は症状があらわれた場合には、速やかに担当医に連絡するよう患者を指導すること。[1.1、1.2、2.1、9.1.1、11.1 参照]
8.2 本剤投与に先立って結核に関する十分な問診及び胸部X線検査に加えインターフェロンγ遊離試験又はツベルクリン反応検査を行い、適宜胸部CT検査等を行うことにより、結核感染の有無を確認すること。また、本剤投与中も、胸部X線検査等の適切な検査を定期的に行うなど結核症の発現には十分に注意し、結核を疑う症状(持続する咳、体重減少、発熱等)が発現した場合には速やかに担当医に連絡するよう患者を指導すること。なお、結核の活動性が確認された場合は結核の治療を優先し、本剤を投与しないこと。[1.1、2.2、9.1.2 参照]
8.3 本剤投与中は、生ワクチン接種による感染症発現のリスクを否定できないため、生ワクチン接種は行わないこと。
8.4 他の生物製剤から変更する場合は、感染症の徴候について患者の状態を十分に観察すること。
8.5 臨床試験において皮膚及び皮膚以外の悪性腫瘍の発現が報告されている。本剤との因果関係は明確ではないが、悪性腫瘍の発現には注意すること。[1.1、15.1.3 参照]出典:
添付文書
- 【安全性】重大な副作用について
-
添付文書では、重大な副作用について以下の記載をしています。
11.1 重大な副作用
11.1.1 重篤な感染症(0.2%)
ウイルス及び細菌等による重篤な感染症があらわれることがある。重篤な感染症が発症した場合には、感染症が消失するまで本剤を投与しないこと。[1.1、1.2、2.1、8.1、9.1.1 参照]
11.1.2 重篤な過敏症(頻度不明)
アナフィラキシー等の重篤な過敏症があらわれることがある。出典:
添付文書
- 【安全性】相互作用について
-
インタビューフォームでは、相互作用について以下の記載をしています。
併用薬の影響(外国人データ)
本剤投与によるCYPプローブ基質(CYP1A2、2C9、2D6、3A4、2C19)の薬物動態に対する影響を検討するため、中等症から重症の外国人乾癬患者を対象に、CYPプローブカクテル※を投与し(本剤投与前、1日目)、7日間のウォッシュアウト後4週間間隔で本剤200mg を2 回投与したところ(本剤2回投与後、57日目)、本剤投与による各CYPプローブ基質の薬物動態パラメータは以下のとおりであり、各CYP分子種で代謝される薬物の薬物動態に対する影響は認められなかった。
※:カフェイン、ワルファリン+ビタミンK、デキストロメトルファン、ミダゾラム、オメプラゾール出典:
インタビューフォーム
- 【安全性】過量投与した報告はありますか?対処方法は?
-
以下の情報は海外の添付文書の内容ですが、参考情報としてご紹介いたします。
<参考情報>
臨床試験において、最大10mg/kgの静脈内投与では安全性の問題は認めらなかったとの報告があります[1]。過量投与時には、副作用の徴候や症状を注意深く観察し、速やかに適切な対症療法を行うことが推奨されます[1][2]。※「既存治療で効果不十分な尋常性乾癬」に対して承認されている用法・用量は、「通常、成人にはチルドラキズマブ(遺伝子組換え)として、1回100mgを初回、4週後、以降12週間隔で皮下投与する。」です。
出典:
[1]米国添付文書、[2]欧州添付文書
- 【安全性】感染症患者(疑いを含む)への投与はできますか?
-
添付文書では、感染症(重篤な感染症を除く)の患者又は感染症が疑われる患者は「特定の背景を有する患者に関する注意」の項に記載されています。免疫調節剤は一般に感染症の回復に影響を与える恐れがあるためです。
また、添付文書の警告及び重大な副作用の記載の通り、重篤な感染症の報告があり、感染症患者に関わらず、チルドラキズマブの投与により感染症のリスクを増大させる可能性があります。チルドラキズマブの投与に際しては十分な観察を行い、感染症の発症や増悪に注意してください。感染症の徴候又は症状があらわれた場合には、速やかに担当医に連絡するよう患者に指導してください。また、重篤な感染症が発症した場合には、適切な処置を行ってください。出典:
添付文書