製品概要
| 先発品名 | カンプト点滴静注40mg、トポテシン点滴静注40mg |
|---|---|
| 一般名 | 日局イリノテカン塩酸塩水和物 |
| 薬効分類名 | 抗悪性腫瘍剤 |
| 適応症 | 小細胞肺癌、非小細胞肺癌、子宮頸癌、卵巣癌、胃癌(手術不能又は再発)、結腸・直腸癌(手術不能又は再発)、乳癌(手術不能又は再発)、有棘細胞癌、悪性リンパ腫(非ホジキンリンパ腫)、小児悪性固形腫瘍、治癒切除不能な膵癌 |
| 先発品との「効能・効果」、「用法・用量」の同異 | 同じ |
| 添加物 | D-ソルビトール90mg、乳酸、pH調節剤(水酸化ナトリウム) |
各種コード
この表は横にスクロールできます
| 包装 | 2ml・1V | 薬価基準収載医薬品コード | 4240404A1016 | |
|---|---|---|---|---|
| YJコード | 4240404A1172 | HOTコード(13桁) | 1190038020101 | |
| レセプト電算処理コード | 621900302 | GS1コード | 調剤単位 | 04987047210080 |
| 統一商品コード | 047110083 | 販売単位 | 14987047110080 | |
| 梱包単位 | 24987047110087 | |||
各種資料
- 添付文書
- 総合製品情報概要
- インタビューフォーム
- RMP・適正使用ガイド
-
使用上の注意改訂
のお知らせ - 服薬指導ガイド
- 患者向け医薬品ガイド
- くすりのしおり
- 標準品との比較表
- 配合変化表
- 包装変更のお知らせ
- その他のお知らせ
診療サポート(患者向け指導せん)
安全性情報
| イリノテカンにおける重篤な副作用症例一覧 |
サンファーマによる承継(2020.12.01)以前に大鵬薬品により収集された重篤な副作用症例一覧は、収集期間中に報告された副作用症例で、独立行政法人医薬品医療機器総合機構に報告を行った内容を掲載しております。 |
よくあるご質問
本製品について、よくいただくご質問と回答をまとめましたのでご確認ください。
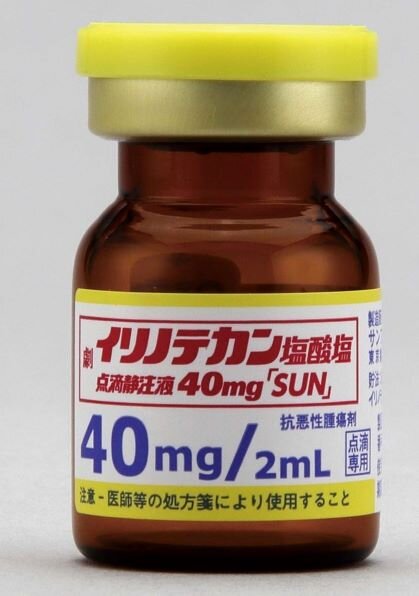
- 【製剤】イリノテカン塩酸塩点滴静注液40mg「SUN」の製剤識別性の特徴を教えてください。
-
バイアルの識別性を高めるために、プラスチックキャップを規格別に色分けし、製品名や含量を表示したのに加え、アルミ部も色分けして製品名や含量を表示し、プラスチックキャップを取り外しても容易に識別できるようにしています。
※イリノテカンの製剤写真をご参照ください。
- 【製剤】イリノテカン塩酸塩点滴静注液40mg「SUN」のバイアルの口径を教えてください。
-
イリノテカン40mgのバイアルサイズは以下のとおりです。
口外径:19.7±0.3mm
口内径:12.4±0.3mm
※イリノテカン100mgのバイアルサイズも同じです。
- 【安全性】イリノテカンの主な重大な副作用は何ですか。
-
イリノテカンの用量規制因子(DLF)は、白血球減少と下痢です。重篤な経過をたどることがあるので注意が必要です。
投与予定日(投与前24時間以内)に末梢血液検査を必ず実施し、結果を確認してから本剤の投与の適否を慎重に判断してください。また、投与開始後は、患者の状態を十分に把握し、異常が認められた場合には、投与を中止または延期し、適切な処置を行ってください。
出典:
添付文書【警告】
- 【安全性】副作用の骨髄機能抑制について教えてください。
-
骨髄機能抑制のある患者では、骨髄機能抑制が増悪して重症感染症等を併発し、致命的となることがあるので、禁忌です。
骨髄機能抑制、高度な下痢等の重篤な副作用が起こることがあり、ときに致命的な経過をたどることがあるので、頻回に臨床検査(血液検査、肝機能検査、腎機能検査等)を行うなど、患者の状態を十分に観察してください。異常が認められた場合には減量、休薬等の適切な処置を行ってください。投与後2週間は特に頻回に末梢血液検査を行うなど、極めて注意深く観察するようにしてください。また、使用が長期間にわたると副作用が強くあらわれ、遷延することがあるので、投与は慎重に行ってください。
本剤の投与の際には、白血球の変動に十分留意し、投与予定日の白血球数が3,000/mm3未満又は血小板数が10万/mm3未満(膵癌FOLFIRINOX法においては、2クール目以降7.5万/mm3未満)の場合には、投与を中止又は延期してください。投与予定日の白血球数が3,000/mm3以上かつ血小板数が10万/mm3以上(膵癌FOLFIRINOX法においては、2クール目以降7.5万/mm3以上)であっても、白血球数又は血小板数が急激な減少傾向にあるなど、骨髄機能抑制が疑われる場合には、本剤の投与を中止又は延期してください。また、白血球数が異常な高値を示す患者及びCRPが異常値を示すなど感染症が疑われる患者では、投与後に白血球の急激な減少が起こることがございます。このような場合には、投与予定日の白血球数が3,000/mm3以上かつ血小板数が10万/mm3以上(膵癌FOLFIRINOX法においては、2クール目以降7.5万/mm3以上)であっても、骨髄機能の回復を十分に確認してから投与してください。白血球減少(好中球減少)を認めた場合には、観察を十分に行い、減少の程度に応じてG-CSF等の白血球増多剤の投与、発熱を伴う場合には適切な抗生剤の投与、その他必要に応じて適切な感染症対策を行ってください。
出典:
添付文書【使用上の注意】2. 重要な基本的注意(4)
- 【安全性】腎障害患者への投与について教えてください。
-
腎障害のある患者には低用量から投与を開始し、副作用の発現に十分注意しながら慎重に投与することが望ましいと考えられます。
出典:
添付文書【使用上の注意】1. 慎重投与(2)
- 【安全性】透析患者への投与について教えてください。
-
現時点において、透析患者への明確な投与方法は確立していません。
なお、腎障害のある患者に対して、イリノテカンは慎重投与となっています。
低用量から投与を開始し、副作用の発現に十分注意しながら慎重に投与することが望ましいと考えられます。また全身状態が悪いような患者さんへの投与は避けたほうが良いと考えられます。
- 【安全性】肝障害患者への投与について教えてください。
-
肝障害のある患者には慎重投与となっています。
頻回に臨床検査(肝機能検査等)を行うなど患者さまの状態を十分に観察しながら慎重に投与を行ってください。
出典:
添付文書【使用上の注意】1. 慎重投与(1)
- 【安全性】妊婦、産婦、授乳婦等に投与できますか。
-
<妊婦又は妊娠している可能性のある女性>
動物実験(ラット・ウサギ)で催奇形性作用、胚・胎児死亡が報告されていますので、妊婦又は妊娠している可能性のある女性には投与しないようにお願いします。また、妊娠する可能性のある女性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導をお願いします。
パートナーが妊娠する可能性のある男性には、本剤投与中及び投与終了後一定期間は適切な避妊をするよう指導をお願いします。[ほ乳類培養細胞を用いた染色体異常試験及びマウス骨髄細胞を用いた小核試験において、遺伝毒性が報告されています。]<授乳婦>
動物実験(ラット)で乳汁中に移行することが報告されていますので、授乳中の女性に投与する場合は、授乳を中止するようにしてください。
出典:
添付文書【使用上の注意】6. 妊婦、産婦、授乳婦への投与
- 【安全性】小児への投与について教えてください。
-
本剤を含む小児悪性固形腫瘍に対するがん化学療法は、小児のがん化学療法に十分な知識・経験を持つ医師のもとで実施してください。
- (1)小児悪性固形腫瘍
幼児又は小児に投与する場合には、副作用の発現に特に注意し、慎重に投与してください。低出生体重児、新生児又は乳児に対する安全性は確立していません。[使用経験が少ない。] - (2)小児悪性固形腫瘍以外
低出生体重児、新生児、乳児、幼児又は小児に対する安全性は確立していません。[使用経験が少ない。]
出典:
添付文書【使用上の注意】1. 慎重投与(7)、7. 小児等への投与
- (1)小児悪性固形腫瘍
- 【安全性】高齢者への投与について教えてください。
-
一般に高齢者では生理機能が低下しており、排泄が遅れることから、骨髄機能抑制、下痢等の副作用に注意し、異常が認められた場合には、回復を十分に確認してから投与を行うなど、投与間隔に留意してください。
出典:
添付文書【使用上の注意】1. 慎重投与(6)、5. 高齢者への投与
- 【安全性】糖尿病患者への投与について教えてください。
-
高度な下痢の持続により脱水、電解質異常を起こして糖尿病が増悪し、致命的となるおそれがありますので、十分な管理を行いながら慎重な投与をお願いします。
出典:
添付文書【使用上の注意】1. 慎重投与(3)
- 【用法】イリノテカンと放射線治療を併用してもよいですか。
-
併用により殺細胞作用が増強され、骨髄機能抑制、下痢等の副作用が増強するおそれがあるため、併用注意となっています。
患者の状態を観察しながら、イリノテカンの減量又は投与間隔を延長(イリノテカンの休薬期間を延長)する事をご検討ください。
出典:
添付文書【使用上の注意】3. 相互作用(2)併用注意
- 【安全性】相互作用の報告のある食品はありますか。
-
グレープフルーツジュース、セイヨウオトギリソウ(St. John's Wort:セント・ジョーンズ・ワート)含有食品が報告されています。
グレープフルーツジュースは、CYP3A4阻害作用があるため、本剤のCYP3A4による無毒化が阻害されることにより、カルボキシルエステラーゼによる活性代謝物(SN-38)の生成が増加し、SN-38の全身曝露量が増加することが考えられ、骨髄抑制、下痢等の副作用が増強するおそれがあります。
また、セイヨウオトギリソウ(St. John's Wort:セント・ジョーンズ・ワート)含有食品は、CYP3A4誘導作用があるため、CYP3A4による本剤の無毒化が促進されることにより、カルボキシルエステラーゼによるSN-38の生成が減少し、SN-38の全身曝露量が減少して本剤の効果が減弱するおそれがあります。
出典:
添付文書【使用上の注意】3. 相互作用(2)併用注意
- 【安全性】血管外漏出時の危険性とその処置を教えてください。
-
イリノテカンは、炎症性薬剤に区分されます。
血管外漏出が認められた場合、院内の血管外漏出時の対応フローチャートに沿って対応してください。
本剤に対する解毒剤はありません。血管外漏出が認められた場合は、注射針を抜かずに直ちに薬剤注入を停止してください。可能な限り薬剤を吸引除去し、陰圧をかけながら留置針を抜去します(チューブや注射針に残存する薬液除去目的で行う)。
その後、ステロイド局注、冷却、局所麻酔剤で炎症や疼痛を抑える処置を行い、経過観察してください。皮膚壊死を疑う場合には、早期に皮膚科などの専門医に相談してください1)。
出典:
1)がん診療レジデントマニュアル第8版(国立がん研究センター内科レジデント編 医学書院)2019; 459,461